Struktur Inti
Struktur Inti -Dalam topik ini kalian akan belajar tentang struktur inti atom. Bahasan kali ini dimulai dengan konsep inti atom, konfigurasi susunan inti atom, dan karakteristik inti atom.
Perumusan struktur inti diawali dengan sejarah perkembangan konsep inti atom. Sebelum mempelajari tentang inti atom, kalian harus memahami definisi dan sejarah penemuan atom. Konsep atom pertama kali dicetuskan oleh John Dalton. Daltonmengemukakan bahwa atom merupakan bagian terkecil dari suatu zat yang tidak dapat dibagi lagi dengan reaksi kimia biasa. Teori atom Dalton tersebut disempurnakan oleh Thomson yang berhasil menemukan partikel penyusun atom, yaitu elektron. Model Thomson juga memiliki kelemahan dan akhirnya disempurnakan oleh Rutherford. Eksperimen Rutherford ini dikenal dengan nama hamburan Rutherford.
 |
| Struktur Inti |
Dari eksperimen ini, Rutherford menyimpulkan bahwa massa seluruh atom bermuatan positif dan terkumpul pada suatu titik yang disebut inti atom. Jadi, konsep inti atom dikemukakan pertama kali oleh Rutherford. Muatan positif yang terdapat pada inti atom sama dengan jumlah muatan elektron yang bergerak mengelilingi inti. Partikel yang bermuatan positif dalam inti atom disebut proton.
Eksperimen Rutherford ini memiliki kelemahan, yaitu tidak dapat menjelaskan tentang beberapa sifat inti atom. Muatan dalam inti merupakan kelipatan eksak dari muatan proton, sedangkan massa inti merupakan kelipatan eksak dari massa proton, sehingga dianggap bahwa semua inti tersusun atas proton. Jika ada inti bernomor massa A dan nomor atom Z, maka inti tersebut mengandung A proton dan (A-Z) elektron. Hipotesis proton-elektron ini memiliki kelemahan, yaitu elektron di dalam inti harus memiliki panjang gelombang de Broglie yang lebih kecil daripada ukuran inti (10-12 cm). Pada kenyataannya, elektron dengan panjang gelombang de Broglie ini memiliki energi kinetik yang lebih besar daripada partikel beta yang dipancarkan oleh inti atom. Oleh karena itu, hipotesis proton-elektron menimbulkan keraguan bahwa elektron bebas merupakan partikel penyusun inti atom.
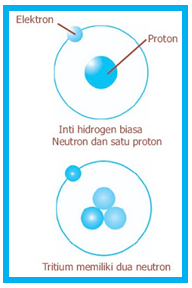
James Chadwick mampu menyempurnakan kelemahan teori Rutherford ini dengan menemukan neutron. Neutron merupakan partikel penyusun inti atom yang tidak bermuatan (netral). Dengan demikian, inti atom tersusun oleh dua partikel, yaitu proton dan neutron. Proton bermuatan positif sedangkan neutron tidak bermuatan atau netral. Proton dan neutron penyusun inti atom ini disebut sebagai nukleon atau nuklida. Berikut ini ilustrasi struktur inti atom partikel hidrogen dan tritium.

Neutron memiliki massa yang hampir sama dengan proton. Inti atom dilambangkan ZXA. X menyatakan nama unsur, Z menyatakan nomor atom, dan A menyatakan nomor massa atom. Inti atom karbon memiliki nomor atom 6 sedangkan nomor massanya 12, sehingga lambang atom karbon tersebut ditulis 6C12. Nomor atom menyatakan jumlah proton dalam inti atom atau jumlah elektron yang mengelilingi inti, sedangkan nomor massa menyatakan jumlah proton dan neutron yang terdapat pada inti atom. Jumlah proton dan neutron dalam inti (disebut nukleon) dinyatakan sebagai nomor atom (A). Jumlah neutron dalam inti dirumuskan dengan A-Z.
Nuklida adalah suatu campuran nukleon tertentu yang membentuk jenis inti atom tertentu.
1. Isotop adalah unsur yang memiliki nomor atom (Z) sama, tetapi memiliki nomor massa (A) berbeda. Nuklida ini memiliki sifat kimia yang sama tetapi sifat fisika berbeda.
2. Isobar adalah nuklida -nuklida yang memiliki nomor massa (A) sama, akan tetapi nomor atom (Z) berbeda.
3. Isoton adalah nuklida yang memiliki jumlah neutron sama.
1. Isotop adalah unsur yang memiliki nomor atom (Z) sama, tetapi memiliki nomor massa (A) berbeda. Nuklida ini memiliki sifat kimia yang sama tetapi sifat fisika berbeda.
2. Isobar adalah nuklida -nuklida yang memiliki nomor massa (A) sama, akan tetapi nomor atom (Z) berbeda.
3. Isoton adalah nuklida yang memiliki jumlah neutron sama.
Selanjutnya, kita akan beranjak ke pembahasan tentang karakteristik inti atom, yaitu mengenai massa dan energi ikat inti. Ukuran inti atom bekisar 10-15 m, sehingga massa partikelnya sangat kecil. Satuan massa inti atom yang digunakan secara internasional adalah satuan massa atom dan disingkat sma. 1 sma = 1,6604 x 10-27 kg. 1 sma didefinisikan sebagai massa atom karbon 6C12. Dari konsep kesetaraan massa dan energi diperoleh 1 sma mengandung energi 1,492232 x 10-10 J = 931,48 MeV. Massa atom berbagai unsur kimia bernilai lebih besar daripada berat atomnya. Hal ini biasa dikenal dengan defek massa. Defek massa sendiri didefinisikan sebagai perbedaan antara total massa nukleon dengan massa inti. Secara matematis, dirumuskan sebagai berikut.
Defek massa (Δm) = Total massa nukleon – massa inti
Defek massa (Δm) = Z x massa proton + (A-Z) x massa netron – massa inti
Defek massa (Δm) = Z x massa proton + (A-Z) x massa netron – massa inti
Energi ikat inti adalah energi yang dilepaskan saat penyusun inti bergabung membentuk inti. Tingkat stabilitas inti dipengaruhi oleh energi ikat dan ukuran nukleon. Inti dengan nukleon yang lebih besar akan memiliki tingkat stabilitas yang rendah. Besarnya energi yang berhubungan langsung dengan stabilitas inti adalah energi ikat per nukleon yang besarnya dapat dihitung melalui persamaan sebagai berikut.
Keterangan:
En = energi ikat per nukleon (MeV) ;
E = energi ikat inti (MeV); dan
A = jumlah nukleon.
En = energi ikat per nukleon (MeV) ;
E = energi ikat inti (MeV); dan
A = jumlah nukleon.
Tags:
fisika





