Contoh Soal Kepolaran senyawa
Contoh Soal Kepolaran senyawa - Atom-atom dengan nilai elektronegativitas yang berbeda berikatan secara kovalen (pemakaian bersama pasangan elektron) untuk membentuk molekul-molekul polar. Derajat kepolaran dalam suatu molekul berpengaruh pada seberapa kuat molekul tersebut tertarik ke molekul lain dalam suatu zat. Dalam hal ini, kepolaran senyawa atau molekul adalah suatu karakteristik senyawa yang berkaitan dengan muatan listrik dan magnet. Kepolaran dapat mempengaruhi sifat-sifat fisik suatu zat. Kita dapat meramalkan kepolaran suatu molekul jika kita mengetahui elektronegativitas atom-atom penyusun molekul tersebut.

1.Molekul Polar
Molekul polar merupakan molekul yang mampu menghasilkan muatan positif dan negatif di tempat yang berbeda. Hal ini akan menyebabkaan molekul tersebut mempunyai kutub negatif dan kutub positif yang disebut dipol. Oleh karena itu, molekul tersebut berperilaku seperti sebuah magnet dengan kutub utara dan kutub selatan. Dipol ikatan dapat digambarkan dengan anak panah, dengan ujung anak panah menyatakan kutub negatif dan pangkalnya menyatakan kutub positif. Coba perhatikan gambar berikut ini.
Molekul polar merupakan molekul yang mampu menghasilkan muatan positif dan negatif di tempat yang berbeda. Hal ini akan menyebabkaan molekul tersebut mempunyai kutub negatif dan kutub positif yang disebut dipol. Oleh karena itu, molekul tersebut berperilaku seperti sebuah magnet dengan kutub utara dan kutub selatan. Dipol ikatan dapat digambarkan dengan anak panah, dengan ujung anak panah menyatakan kutub negatif dan pangkalnya menyatakan kutub positif. Coba perhatikan gambar berikut ini.

Gambar 1. Dipol dalam molekul yang terdiri dari atom-atom X dan Y
Ukuran kekuatan dipol dalam suatu molekul polar disebut momen dipol. Momen dipol merupakan jumlah vektor dipol-dipol individu dalam suatu molekul. Kekuatan momen dipol bergantung pada besarnya muatan listrik, jarak antar muatan dan susunan muatannya. Untuk molekul-molekul polar mempunyai nilai momen dipol tertentu, sedangkan molekul-molekul nonpolar nilai momen dipolnya sama dengan nol. Molekul-molekul polar terbentuk ketika suatu atom elektronegatif berikatan dengan atom elektropositif, sehingga atom yang yang elektronegatif menarik pasangan-pasangan elektron ikatan ( PEI ) menjauh dari atom yang lain. Dengan kata lain, satu sisi dari molekul yang terbentuk bermuatan negatif dan sisi yang lain bermuatan positif. Contoh molekul-molekul polar adalah HCl, H2O, NH3, HF, dan lain-lain. Semakin besar nilai selisih elektronegativitas antara atom-atom dalam suatu molekul, semakin kuat kepolaran molekul tersebut. Tidak hanya perbedaan keelektronegtifan, tetapi geometri suatu molekul dapat mempengaruhi kepolarannya. Sebagai contoh ikatan antara atom C dan atom Cl merupakan ikatan polar, tetapi CCl4 merupakan molekul nonpolar. Hal ini karena geometri molekul ini simetris, sehingga dipol-dipol dalam ikatan-ikatannya saling meniadakan satu sama lain dan momen dipol sama dengan nol.
2.Molekul Nonpolar
Molekul nonpolar merupakan suatu molekul yang menghasilkan muatan positif dan negatif di tempat yang sama, sehingga molekul tersebut tidak mempunyai dipol. Dalam hal ini dipol merupakan dua kutub yang sama dan berlawanan yang termagnetisasi atau bermuatan listrik yang dipisahkan oleh jarak. Dipol-dipol individu terdapat dalam ikatan–ikatan suatu molekul. Akan tetapi karena geometri molekul tersebut, maka dipol-dipol itu secara efektif saling meniadakan satu sama lain. Biasanya geometri molekul-molekul nonpolar adalah simetris secara keseluruhan dan molekul-molekul tersebut tidak mempunyai muatan. Dua buah atom dengan nilai elektronegativitas yang sama atau hampir sama akan membentuk suatu molekul nonpolar. Dalam molekul nonpolar ini, elektron-elektron terluar dari atom tersebut akan terdistribusi merata di sekitar pusat molekul dan antarpasangan elektron memiliki ikatan yang kuat. Molekul–molekul nonpolar dapat berupa molekul-molekul monoatomik, seperti H2, I2, O2, Cl2, P4, dan S8 atau molekul-molekul yang atom pusatnya tidak mempunyai pasangan elektron bebas, seperti CO2, CH4, dan C2H6.
Molekul nonpolar merupakan suatu molekul yang menghasilkan muatan positif dan negatif di tempat yang sama, sehingga molekul tersebut tidak mempunyai dipol. Dalam hal ini dipol merupakan dua kutub yang sama dan berlawanan yang termagnetisasi atau bermuatan listrik yang dipisahkan oleh jarak. Dipol-dipol individu terdapat dalam ikatan–ikatan suatu molekul. Akan tetapi karena geometri molekul tersebut, maka dipol-dipol itu secara efektif saling meniadakan satu sama lain. Biasanya geometri molekul-molekul nonpolar adalah simetris secara keseluruhan dan molekul-molekul tersebut tidak mempunyai muatan. Dua buah atom dengan nilai elektronegativitas yang sama atau hampir sama akan membentuk suatu molekul nonpolar. Dalam molekul nonpolar ini, elektron-elektron terluar dari atom tersebut akan terdistribusi merata di sekitar pusat molekul dan antarpasangan elektron memiliki ikatan yang kuat. Molekul–molekul nonpolar dapat berupa molekul-molekul monoatomik, seperti H2, I2, O2, Cl2, P4, dan S8 atau molekul-molekul yang atom pusatnya tidak mempunyai pasangan elektron bebas, seperti CO2, CH4, dan C2H6.
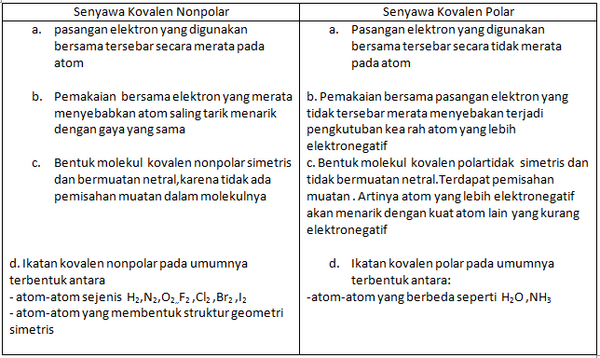
3.Perbandingan antara Senyawa Kovalen Nonpolar dan Kovalen Polar

S1
Kepolaran senyawa pada umumnya terdapat pada molekul yang atom-atomnya berikatan....
S2
Senyawa kovalen polar terjadi karena perbedaan....
S3
Dari molekul berikut ini yang merupakan molekul polar adalah....
S4
Pada dasarnya, atom C dan Cl memiliki beda keelektronegatifan, tetapi senyawa CCl4 bersifat nonpolar. Hal ini disebabkan karena....
S5
Atom N (NA = 7) berikatan dengan atom H (NA = 1) membentuk molekul NH3. Pasangan elektron yang terdapat dalam susunan NH3 tersebut adalah....
S6
Molekul NH3 merupakan molekul....
S7
Kekuatan momen dipol bergantung pada....
S8
Molekul asam klorida (HCl) bersifat polar karena....
S9
Diketahui harga keelektronegatifan dari dari atom-atom F, Cl, Br, I, dan H berturut-turut 4,3 ; 2,8 ; 2,5 ; dan 2,1. Jika antaratom tersebut saling berikatan, senyawa yang paling polar adalah....
S10
Senyawa-senyawa berikut ini tergolong polar kecuali..
Tags:
Contoh Soal Kimia
