Contoh Soal Teori mekanika kuantum
Contoh Soal Teori mekanika kuantum - Menurut Niels Bohr, elektron beredar mengelilingi inti membentuk orbit lingkaran dengan jari-jari atom tertentu. Hal ini tidak sesuai fakta bahwa gerakan elektron menyerupai gelombang elektromagnetik. Gelombang tidak bergerak menurut suatu garis melainkan menyebar pada suatu daerah tertentu. Tidak mungkin membayangkan suatu gelombang yang bergerak pada satu lingkaran dan selalu pada pada lingkaran itu.
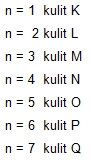



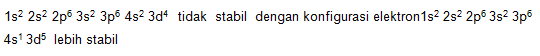
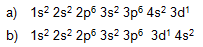
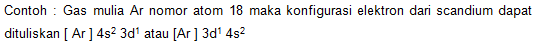
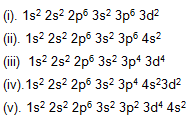
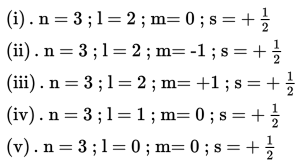
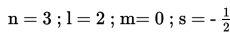
Pada tahun 1927 Erwin Schrodinger, seorang ahli matematika dari Austria mengajukan teori atom yang disebut teori atom Mekanika Kuantum. Menurut teori ini, kedudukan elektron dalam atom tidak dapat ditentukan dengan pasti, yang dapat ditentukan adalah probabilitas menemukan elektron pada posisi dan waktu tertentu. Daerah dengan probabilitas terbesar menemukan elektron itu disebut orbital. Orbital digambarkan seperti awan yang ketebalannya menyatakan kebolehjadian menemukan elektron di daerah itu. Bentuk dan tingkat energi elektron diperoleh dari persamaan gelombang ketidakpastian. Kemudian pada tahun 1927 Werner Heisenberg seorang ahli fisika dari Kopenhagen Denmark menguatkan teori atom Mekanika Kuantum dengan munculnya asas ketidakpastian. Heisenberg mengemukakan bahwa semua metode eksperimen yang digunakan untuk menentukan posisi atau momentum suatu elektron dapat menyebabkan perubahan baik posisi atau momentumnya. Heisenberg mengembangkan persamaan–persamaan matematika untuk menunjukkan bahwa tidak ada metode eksperimen yang dapat dirancang untuk mengukur dengan serempak posisi maupun momentum elektron. Jika eksperimen dirancang untuk memastikan momentum atau kecepatan elektron ,maka posisinya menjadi tidak pasti. Model atom mekanika kuantum mempunyai persamaan dengan model atom Bohr dalam hal adanya tingkat-tingkat energi.
Setelah membahas tentang sejarah mekanika kuantum, saatnya kita mempelajari mekanisme yang terjadi di dalamnya. Mekanisme utama yang menjadi topik pembahasan dalam mekanika kuantum adalah elektron. Banyak hal-hal yang harus diperhatikan dalam membahas elektron ini, salah satunya dengan memperhatikan bilangan-bilangan kuantumnya.
Setelah membahas tentang sejarah mekanika kuantum, saatnya kita mempelajari mekanisme yang terjadi di dalamnya. Mekanisme utama yang menjadi topik pembahasan dalam mekanika kuantum adalah elektron. Banyak hal-hal yang harus diperhatikan dalam membahas elektron ini, salah satunya dengan memperhatikan bilangan-bilangan kuantumnya.
Mengenal Macam-Macam Bilangan Kuantum
a. Bilangan kuantum utama (N)
Bilangan kuantum utama menyatakan tingkat energi utama dalam kulit atom.
Bilangan kuantum utama menyatakan tingkat energi utama dalam kulit atom.
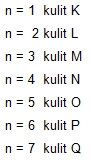
Adapun susunan sub kulit berdasarkan tingkat energinya, akan dijabarkan sebagai berikut.
Kulit 1 = s
Kulit 2 = s p
Kulit 3 = s p d
Kulit 4 = s p d f
Kulit 5 = s p d f
Kulit 6 = s p d f
Kulit 7 = s p d f
b. Bilangan Kuantum Azimuth ( l )
Kulit 1 = s
Kulit 2 = s p
Kulit 3 = s p d
Kulit 4 = s p d f
Kulit 5 = s p d f
Kulit 6 = s p d f
Kulit 7 = s p d f
b. Bilangan Kuantum Azimuth ( l )

c. Bilangan Kuantum Magnetik ( m )

d. Bilangan Kuantum Spin (s)
Menyatakan arah perputaran elektron. Nilai spin (-) menyatakan bahwa perputaran elektron berlawanan arah jarum jam, sedangakn (+) menyatakan searah dengan jarum jam.
Menyatakan arah perputaran elektron. Nilai spin (-) menyatakan bahwa perputaran elektron berlawanan arah jarum jam, sedangakn (+) menyatakan searah dengan jarum jam.
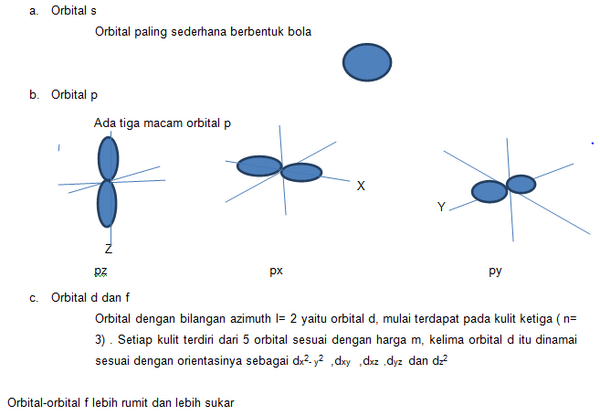
Bentuk dan orientasi orbital
Bentuk orbital tergantung pada bilangan kuantum azimuth (l) artinya orbital dengan bilangan kuantum yang sama akan mempunyai bentuk yang sama. Orbital 1s, 2s dan 3s mempunyai bentuk yang sama, tetapi ukuran dan tingkat energinya berbeda.
Bentuk orbital tergantung pada bilangan kuantum azimuth (l) artinya orbital dengan bilangan kuantum yang sama akan mempunyai bentuk yang sama. Orbital 1s, 2s dan 3s mempunyai bentuk yang sama, tetapi ukuran dan tingkat energinya berbeda.

Konfigurasi Elektron
Untuk menggambarkan distribusi elektron dalam atom digunakan konfigurasi elektron
a. Aturan–aturan Penulisan Konfigurasi Elektron
a. Aturan–aturan Penulisan Konfigurasi Elektron
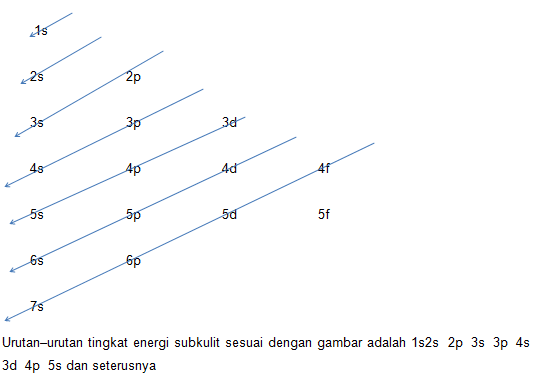
1.Azas Aufbau
Pengisian orbital selalu dimulai dari subkulit dengan tingkat energi yang rendah kemudian ke tingkat energi yang lebih tinggi.
Urutan–urutan tingkat energi ditunjukkan oleh gambar berikut.
Pengisian orbital selalu dimulai dari subkulit dengan tingkat energi yang rendah kemudian ke tingkat energi yang lebih tinggi.
Urutan–urutan tingkat energi ditunjukkan oleh gambar berikut.

2.Azas larangan Pauli
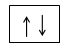
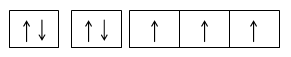
Tidak ada dua elektron dalam satu atom yang mempunyai bilangan kuantum spin yang sama. Dua elektron yang menempati satu orbital mempunyai bilangan kuantum utama, azimuth dan magnetik yang sama, dan mempunyai spin yang berbeda. Kedua elektron ini disebut berpasangan dan dapat dinyatakan dengan gambar berikut.
Tidak ada dua elektron dalam satu atom yang mempunyai bilangan kuantum spin yang sama. Dua elektron yang menempati satu orbital mempunyai bilangan kuantum utama, azimuth dan magnetik yang sama, dan mempunyai spin yang berbeda. Kedua elektron ini disebut berpasangan dan dapat dinyatakan dengan gambar berikut.

Gambar Spin Up dan Spin Down
Dengan demikian satu orbital hanya dapat ditempati oleh dua elektron.
Jadi, jumlah maksimum elektron pada setiap subkulit sama dengan dua kali jumlah orbitalnya.
Jadi, jumlah maksimum elektron pada setiap subkulit sama dengan dua kali jumlah orbitalnya.

3.Kaidah Hund
Pada pengisian orbital-orbital dari satu subkulit,mula-mula elektron akan menempati orbital secara sendiri-sendiri dengan spin yang parallel,baru kemudian berpasangan.Hal ini akan meminimalkan tolak menolak antara elektron tersebut.
Contoh: N nomor atom = 7 konfigurasi elektronnya 1s2 2s2 2p3.
Bentuk orbitalnya sebagai berikut.
Pada pengisian orbital-orbital dari satu subkulit,mula-mula elektron akan menempati orbital secara sendiri-sendiri dengan spin yang parallel,baru kemudian berpasangan.Hal ini akan meminimalkan tolak menolak antara elektron tersebut.
Contoh: N nomor atom = 7 konfigurasi elektronnya 1s2 2s2 2p3.
Bentuk orbitalnya sebagai berikut.

Gambar orbital sub kulit 1s2 2s2 2p3
4.Aturan penuh dan setengah penuh yang stabil untuk orbital d
Contoh : Cr nomor atom 24 dengan konfigurasi sebagai berikut.
Contoh : Cr nomor atom 24 dengan konfigurasi sebagai berikut.
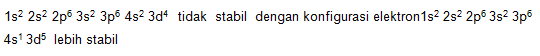
b.Beberapa Catatan tentang Konfigurasi Elektron
1.Ada dua cara menuliskan urutan subkulit
Contoh : menuliskan konfigurasi elektron scandium nomor atom =21.
1.Ada dua cara menuliskan urutan subkulit
Contoh : menuliskan konfigurasi elektron scandium nomor atom =21.
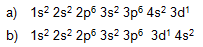
2.Menyingkat Penulisan Konfigurasi Elektron dengan Menuliskan Konfigurasi Elektron Gas Mulia
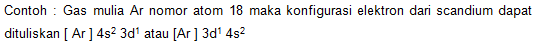
c.Konfigurasi Elektron Ion
Ion tunggal yang bermuatan x+ terbentuk dari atom netral dengan melepas x elektron. Elektron yang dilepas adalah elektron dari kulit terluar
Ion tunggal yang bermuatan x+ terbentuk dari atom netral dengan melepas x elektron. Elektron yang dilepas adalah elektron dari kulit terluar
S1
Kedudukan elektron dalam atom tidak dapat ditentukan dengan pasti, yang dapat ditentukan hanya probabilitas terbesar menemukan elektron di sekitar inti. Pernyataan ini dikemukakan oleh....
S2
Daerah dengan kemungkinan terbesar untuk menemukan elektron disebut....
S3
Atom unsur helium mempunyai lambang 2He. Elektron-elektron dalam atom Helium bisa menduduki bilangan kuantum yang sama, kecuali....
S4
Werner Heisenberg mengemukakan suatu teori penting dalam sejarah mekanika kuantum. Teori tersebut berkaitan dengan....
S5
Di bawah ini akan ditunjukkan konfigurasi beberapa unsur.
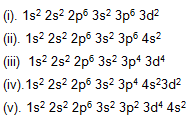
Konfigurasi elektron dari unsur Kalsium (Ca) dengan nomor atom 20 adalah....
S6
Banyaknya elektron yang menempati subkulit d adalah....
S7
Jumlah elektron yang belum berpasangan pada atom besi (Fe) dengan nomor atom 26 adalah....
S8
Di bawah ini terdapat beberapa susunan bilangan kuantum.
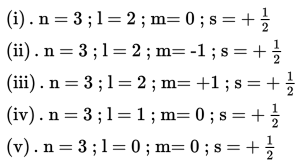
Susunan bilangan kuantum dari unsur Natrium dengan nomor atom 11 terdapat pada nomor....
S9
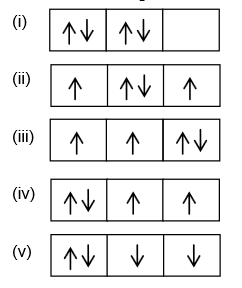
Nomor atom oksigen adalah 8 dengan konfigurasi elektron 1s2 2s2 2p4.

Berdasarkan konfigurasi di atas, susunan elektron pada orbital 2p yang benar menurut kaidah Hund adalah....
S10
Diketahui nilai keempat bilangan kuantum elektron atom X sebagai berikut.
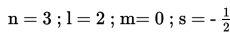
Nomor atom X adalah....
Tags:
Contoh Soal Kimia

